認識原電池與電解電池
電化學和電化學電池中引入了我們對糖尿病監測的單位。在這里,您可以查看該頁面。電化學電池中的電路,它允許通過它電子的轉移。該單元包括:
一個陽極,電極中的氧化發生
一個陰極,電極中的減少發生
電解質,以允許在每個半電池內的溶液中的離子傳導
一個鹽橋或半透膜,允許一半細胞之間的離子傳導
在兩個電極連接的外部電路,包括電線,負載,和米
原電池
一種電化學電池,釋放的能量被稱為原電池。的電化學反應的吉布斯自由能的負值和陽性細胞的電勢差。 下面是一個原電池,其中甲+和B 之間的反應是放熱的,在標準條件下,與G的-10 kJ / mol的和Ë 0值的0.10 V。

氫電極和半反應
我們有表顯示還原半反應。這些是如何得到的一種電化學電池的電化學反應,同時需要減少一半的反應和氧化半反應。電路中的電壓表顯示總的電池電壓(E TOT = Ë 紅色 + é 牛)。我們可以確定半電池電位測量的小區,包括已知的可能與一個標準的半電池一起,半電池的電壓。 公認的標準電極是氫電極。這包括與不反應的金屬電極的半電池,H 2(g)在1個大氣壓的壓力下,和1M的酸的水溶液。 在還原模式中:2H + + 2e的- Ĥ é 紅 = 0.00 V
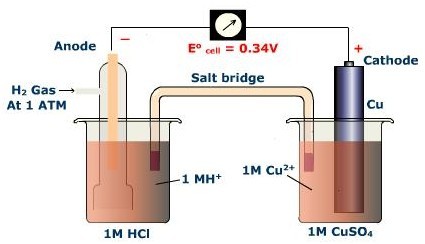
在氧化模式中:ħ 2 2H + + 2e的- é 紅 = 0.00 V
您可以在這里看到的Cu 2被還原成Cu 半電池的電位為0.34 V。
減少 銅+2 + 2E - 銅 Ë 紅色 = X
氧化 H 2 2H + + 2e的- Ë 牛 = 0.00 V
凈 銅2 + H 2 銅+ 2H + Ë TOT = 0.34 V
電解電池
一種電解池具有一個吸熱的化學反應。該反應不是自發產生的,所以需要的電源。一種電化學電池,能量被存儲在。這可以釋放能量,當細胞被允許運行中的電偶的模式。
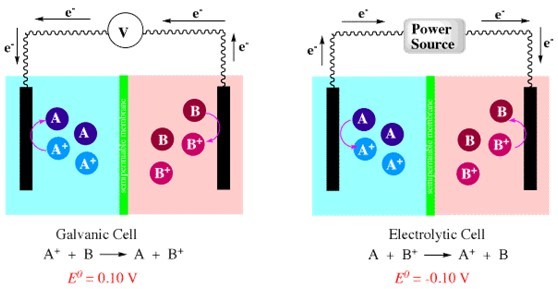
右上的是,我們看到以前的原電池。的分子A和B +產生,并釋放能量。細胞的左側上的電極是陰極,因為A +降低到A,在該電極上。 左上圖,電解模式中是相同的單元格。的能量源使反應自發方向相反的方向去。現在,A+和B。右側上的電極是陰極,因為乙+減少到B。






